薬のお話
- HOME
- 薬のお話
(1)向精神薬の概念と分類 (2)神経伝達の原理 (3)向精神薬の効果発現時期 (4)抗精神病薬 (5)抗うつ薬 (6)抗躁薬 (7)抗不安薬 (8)睡眠薬 (9)ADHD治療薬
(1)向精神薬の概念と分類
向精神薬とは、精神に作用する薬物の総称です。
<向精神薬の分類>
(1)精神科治療薬
- 抗精神病薬=神経遮断薬、強力精神安定薬(メジャー・トランキライザー)
- 抗うつ薬
- 抗躁薬=気分安定薬など
- 抗不安薬=緩和精神安定薬(マイナー・トランキライザー)
- 睡眠薬
- 抗てんかん薬 など
(2)精神異常発現薬
- 幻覚剤 など
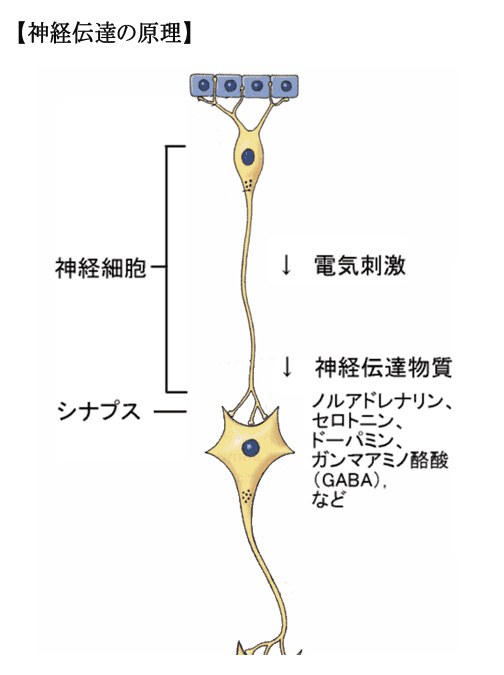
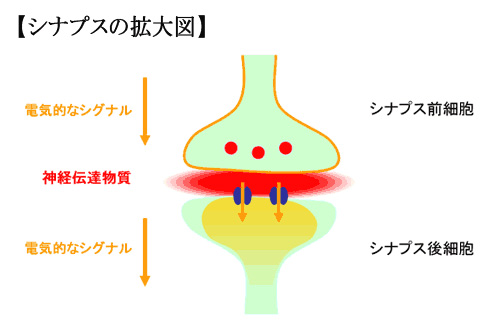
(2)神経伝達の原理
神経伝達の際、神経細胞の中では電気刺激が、シナプスでは神経伝達物質が次の神経細胞に情報を伝達します。
向精神薬は、神経伝達の過程(特にシナプス)に作用します。
(3)向精神薬の効果発現時期
(1)投与後まもなく効果発現し、中止後まもなく効果消失するもの(その日限りの症状を緩和する薬):
鎮静作用、催眠作用、抗不安作用、など
(2)十分量・十分期間投与後初めて効果発現し、中止後しばらくして効果消失するもの:
抗精神病作用、抗うつ作用、抗躁作用、など
ですから、日によって薬を増減しても、(2)では意味がありません。
(4)抗精神病薬
統合失調症の陽性症状(幻覚、妄想など)には、(1)中脳辺縁系のドーパミン神経の活動性増加が関与するという仮説があり、統合失調症の陰性症状(感情鈍麻、意欲低下など)や認知障害には、(2)中脳皮質系のドーパミン神経の活動性低下が関与するという仮説や、脳の構造変化や神経の脱落が関与するという仮説があります。抗精神病薬はこれらの神経系のドーパミンD2受容体を遮断して作用を発揮します。
脳内のドーパミン作動系には、
(1)中脳辺縁系 (2)中脳皮質系 (3)黒質線条体系 (4)結節・漏斗系
があり、これらを遮断すると、下記の作用が見られます。
| (1) | 中脳辺縁系 → 抗精神病作用の発揮 |
| (2) | 中脳皮質系 → 陰性症状の悪化 |
| (3) | 黒質線条体系 → 錐体外路症状(パーキンソン症、アカシジア(静坐不能症)、ジストニア(筋緊張異常)、遅発性ジスキネジア(口が勝手に動く、抗パーキンソン薬無効で、非可逆的、つまり原因薬剤を止めても元に戻らない)) |
| (4) | 結節・漏斗系 → 内分泌影響(プロラクチン↑)(女性化乳房、乳汁分泌、月経異常、インポテンス、体重増加、骨粗しょう症) |
抗精神病薬による副作用が誤って陰性症状ととられている場合があります。
悪性症候群に注意!
抗精神病薬投与中に、
| (1) | 発熱(38℃以上、しばしば40℃以上に達する) |
| (2) | 著しい筋固縮、振戦、嚥下困難などの錐体外路症状 |
| (3) | 無動緘黙、興奮、せん妄、傾眠、昏睡などの意識障害 |
| (4) | 頻脈、発汗、唾液分泌過多、呼吸促迫などの自律神経症状 |
が比較的急激に出現する。
血清CPK(特にMM型)が発症初期より急上昇。
横紋筋融解症を合併すると予後は悪い。
抗精神病薬投与開始後数日以内に発症することが多いが、長期投与でも生じうる。
→ 抗精神病薬の中止、点滴、ダントリウムの投与。
ドーパミン作動系以外の遮断による副作用としては、下記のものがあります。
| (1) | α1受容体遮断 → 体位性低血圧、射精障害 エピネフリン(ボスミン)併用は原則禁。抗精神病薬のようなα1受容体遮断作用を有する薬物使用中は、エピネフリンのα1受容体刺激による血管収縮作用が発現せず、β2受容体刺激による血管拡張作用が出現し、エピネフリンの作用を逆転させ血圧下降を起こすことがあります。 |
| (2) | コリン受容体遮断 → 口が乾く、目がかすむ、排尿障害、便秘、頭の働きが鈍る、依存性があるので急に止めると退薬症状が見られます(抗精神病薬の副作用止めとして使う抗パーキンソン薬のビペリデン(アキネトン)なども、抗コリン薬であるためにこれらの副作用があります。) 一般に抗精神病薬には依存性はありませんが、抗コリン作用の強いものは依存性があり退薬症状がみられます。 |
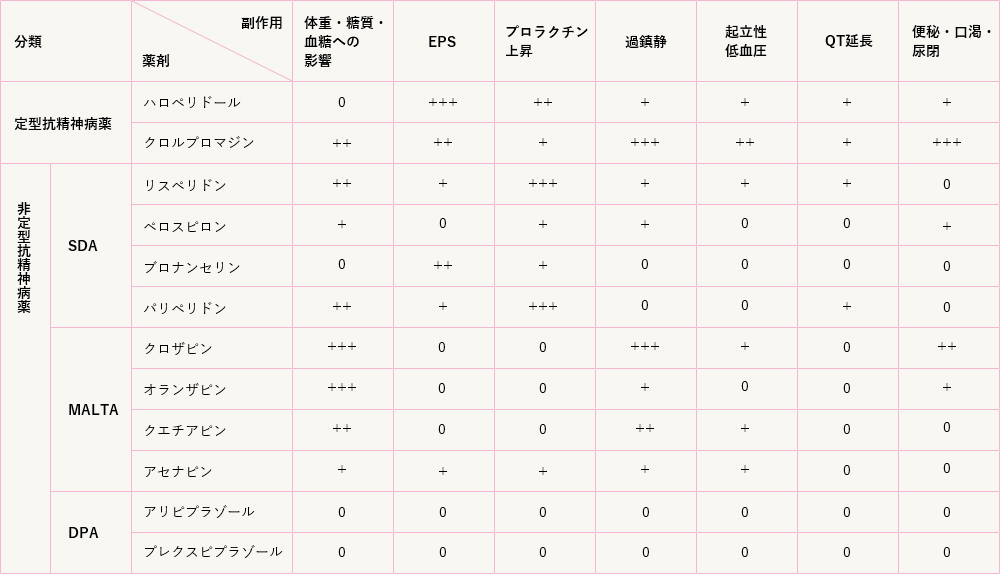
(1)定型抗精神病薬(第一世代)
錐体外路症状、高プロラクチン血症、遅発性ジスキネジアを起こしやすい。
①ブチロフェノン系(ハロペリドール(セレネース)など):抗幻覚妄想作用が強い。
②フェノチアジン系(クロルプロマジン(コントミン)、レボメプロマジン(ヒルナミン、レボトミン)など):鎮静作用が強い。
フェノチアジン系は顆粒球減少症(フェノチアジン系によるアレルギー反応で、投与量とは無関係。服薬3~8週に発症のピーク、死亡率20~50%。発熱、咽頭痛があり、白血球3500以下、好中球30%以下の場合は直ちに投薬を中止し、十分な抗生物質、ステロイド剤などを用いる。)、皮膚色素沈着、角膜・水晶体の混濁を起こします。
(2)非定型抗精神病薬(第二世代)
第一世代に比べて錐体外路症状が少なく、陰性症状にも有効と言われます。第一世代と同様にD2受容体を遮断しますが、(2)中脳皮質系や(3)線条体ではドーパミン神経終末上のセロトニン2A受容体遮断によりドーパミン放出が促進され、それぞれ(2)陰性症状、(3)錐体外路系副作用を軽減、改善すると考えられています。オランザピン、アリピプラゾールには神経保護作用があり、非可逆的である陰性症状の進行を防止するとの報告があります。D2受容体に対する結合親和性は、ブロナンセリン>プレクスピプラゾール≧アリピプラゾール≧アセナピン>>他剤。
①SDA(リスペリドン(リスパダール)、ペロスピロン(ルーラン)、ブロナンセリン(ロナセン)、パリペリドン(リスペリドンの代謝物)(インヴェガ)、ルラシドン(ラツーダ)):
ブチロフェノン系に似ています。中脳皮質系や線条体ではドーパミン神経終末上のセロトニン2A受容体遮断によりドーパミン放出が促進され、それぞれ陰性症状、錐体外路系副作用(EPS)を軽減、改善します。
ペロスピロンは抗不安薬タンドスピロンの誘導体で、セロトニン1A受容体を介する作用により、統合失調症の強迫症状に有効との報告があります。
ブロナンセリンはD2受容体への結合親和性が最も高く、鎮静作用が殆どなく、また血液脳関門を通過して脳内へ移行し易い為、脳下垂体への影響が少なく高プロラクチン血症を起こしにくい。
ルラシドンはヒスタミンH1、ムスカリンM1受容体に対しては結合親和性を殆ど示さない為、体重増加や過鎮静、口渇、便秘などの副作用は非常に少ない。空腹時に服用すると吸収が低下し血中濃度が十分上昇しない為、1日1回食後投与します。
②MALTA(クエチアピン(セロクエル)、オランザピン(ジプレキサ)、アセナピン(シクレスト)):
フェノチアジン系に似ています。D2、セロトニン2A以外にも様々な受容体に結合します。
アセナピンは消化管ではなく舌下粘膜から吸収され、D2受容体に結合親和性が高い。
クエチアピン、オランザピンは糖尿病には禁!
③ドーパミンD2受容体部分作動薬(DPA)(アリピプラゾール(エビリファイ)、プレクスピプラゾール(レキサルティ)):
既存の抗精神病薬は全てドーパミンD2受容体拮抗薬(アンタゴニスト)でした。ドーパミンD2受容体部分作動薬(パーシャルアゴニスト)はドーパミン作動性神経伝達の活動に応じてその神経伝達を常に生理的なレベル方向へ安定化させ、ドーパミン過剰活動の場合にはドーパミンD2受容体に対して拮抗薬として作用し、低下している場合には作動薬として作用します。この為、(1)中脳辺縁系は抑制し、(2)中脳皮質系は抑制を減弱し、(3)黒質線条体系、(4)結節・漏斗系には影響を及ぼしません。
アリピプラゾールは血中濃度の半減期が60時間と長い。不眠となる事があるので、朝1回投与します。
プレクスピプラゾールはアリピプラゾールよりもドーパミンD2受容体遮断作用が強く、アカシジア(静坐不能症)が少ない。SDAと同じく中脳皮質系や線条体ではドーパミン神経終末上のセロトニン2A受容体遮断によりドーパミン放出が促進され、それぞれ陰性症状、錐体外路系副作用(EPS)を軽減、改善します。
<主な抗精神病薬の副作用における比較>
<抗精神病薬の副作用とその対策>
| 分類 | 病状 | 患者への影響 | 原因 | 対策 |
| 定型抗精神病薬 | 鎮静・催眠 | QOLの低下 | 抗α1作用 抗H1作用 |
減量、処方を就寝前に1回にまとめる、DPAに変薬 |
| 肝障害 | SDAやDPAに変薬 | |||
| 起立性低血圧 | 立ちくらみ | 抗α1作用 | 減量、変薬 | |
| 不整脈 | 過量服薬時危険 | 抗コリン作用 抗α1作用 |
減量、変薬 | |
| パーキンソン症状 | QOLの低下 | 抗D2作用 | MALTAやDPAに変薬 | |
| 悪性症候群 | 腎不全、致死的 | 抗D2作用 | 起因薬剤中止、補液、ダントロレン投与 | |
| 遅発性ジスキネジア | 難治 | 抗D2作用 | 減量、MALTAへ変薬、抗コリン薬の中止、ビタミンE投与 | |
| 乳汁分泌 月経異常 |
QOL、アドヒアランスの低下 | 高プロラクチン血症(抗D2作用) | DPAやMALTAに変薬、テルグリドの投与 | |
| SDA | 乳汁分泌 月経異常 射精不能 |
QOL、アドヒアランスの低下 | 高プロラクチン血症(抗D2作用) | DPAやMALTAに変薬、テルグリドの投与 |
| MALTA | 体重増加 | 脂質異常症、アドヒアランスの低下 | 抗H1作用 セロトニン2C(5-HT2C)遮断作用 |
DPAやSDAに変薬、食事療法、運動療法、定型薬も考慮 |
| 血糖上昇 | ケトアシドーシスで死亡例も | 抗H1作用 | SDAに変薬、定型薬も考慮 | |
| DPA | 不眠、不安 | ドパミン刺激 | ベンゾジアゼピン投与 | |
| 胃腸症状 | 嘔気 | ドパミン刺激 | メトクロプラミド、ドンペリドンの投与 |
(5)抗うつ薬
シナプスにおける神経伝達物質のうち、セロトニン、ノルアドレナリン、ドーパミンは、それぞれ気分、意欲、快楽に関係しているとされています。
シナプスにおいてセロトニン、ノルアドレナリンが少なくなると、抑うつ気分、意欲低下などのうつ症状が現れ、抗うつ薬の多くは、シナプス間隙におけるセロトニンあるいはノルアドレナリンの再取り込みを阻害して濃度を増加させ、情報伝達を正常化させる、と考えられてきました(モノアミン仮説)。しかし、モノアミン仮説では、抗うつ薬の効果が出始めるのに2週間もかかる事の説明がつきません。最近では、うつ病では神経細胞の突起が委縮しており、抗うつ薬はモノアミンを増やす事を介してBDNF(脳由来神経栄養因子)を増やし、神経細胞の突起を伸ばす作用により効果を発揮する、という考え方が主流になってきました(神経新生・BDNF仮説)。
抗うつ薬の種類としては、第一世代(三環系)、第二世代(非三環系)、第三世代(SSRI)、第四世代(SNRI)、第五世代(NaSSA)、第六世代(S-RIM)があります。
(1)三環系抗うつ薬
- シナプスでのセロトニン、ノルアドレナリン双方の再取り込み阻害 → 抗うつ作用
- 効果発現に2週間かかる。
- 副作用や安全性の問題はあるが、抗うつ作用は強い。新しい抗うつ薬が効果不十分で、三環系抗うつ薬に変えると有効な場合があります。
- クロミプラミン(アナフラニール)はセロトニン優位で、不安症にも効果があり、SSRIの登場以前はパニック症や強迫症にも使用されていました。
- α1受容体遮断 → 体位性低血圧
- コリン受容体遮断 → 口の乾き、目のかすみ、排尿障害、便秘(アミトリプチリン(トリプタノール)で最も強い)
- けいれん(クロミプラミン(アナフラニール)、四環系のマプロチリン(ルジオミール)で頻度が高い)
- 心毒性と過量投与による危険性(1000mg以上で致死量となる) → 大量服薬に注意!
- 緑内障、心筋梗塞の回復初期には禁!
(2)非三環系抗うつ薬
三環系抗うつ薬よりは副作用が少ないが、抗うつ作用は非常に弱い。
現在は、ミアンセリン(テトラミド)、トラゾドン(デジレル、レスリン)等が睡眠作用を期待して使われます。深い睡眠を増やして悪夢や中途覚醒を軽減します(SSRIとは逆の作用)。アメリカでは、不眠症の治療薬として最も多く使われている薬剤がトラゾドンです。
トラゾドンには、まれだが重篤な副作用として持続勃起症があります。
緑内障、心筋梗塞の回復初期には禁!
(3)SSRI(選択的セロトニン再取り込み阻害薬)
(フルボキサミン(ルボックス、デプロメール)、パロキセチン(パキシル)、セルトラリン(ジェイゾロフト)、エスシタロプラム(レクサプロ))
セロトニンのみに作用し、抗うつ作用はやや弱く、本格的なうつには効果不十分ですが、うつ病以外の適応症(強迫症、パニック症、社会不安症)があります。適応外ですが、摂食障害、PTSDなど(アメリカでは適応)にも使用されます。
三環系抗うつ薬のような抗コリン性の副作用や、心毒性、鎮静作用が少ない。
嘔気、悪心などの消化器症状(服用中に消失することが多い)、眠気、めまい、ふらつき、性機能障害。
急に止めると「フワフワ」「ビリビリ」といった退薬症状が見られます(特にパロキセチン(パキシル))。
血中濃度半減期は、エスシタロプラム>>セルトラリン>パロキセチン>フルボキサミンの順に長く、最高血中濃度到達時間はいずれも5時間以上→夕食後投与で翌朝に眠気等の持ち越しがある場合は、服用時刻を夕から昼にずらす事により、日中の副作用を回避できます。
セロトニン症候群(SS)に注意!
①フルボキサミン(ルボックス、デプロメール):
σ1受容体刺激作用を介した海馬の神経可塑性により認知機能を改善する可能性が示唆されており、老年期の妄想を伴ううつ病にはやや特異的な効果があるとも言われています(尚、PTSDの所見として海馬の委縮がありますが、私見では、PTSDを背景としたうつに有効な印象もあります。)。
②パロキセチン(パキシル):
高用量ではノルアドレナリンにも作用。抗コリン作用あり。
自身を代謝する酵素を阻害する為、投与量を増減すると血中濃度が急速に上下(血中濃度の非線形性)→退薬症状が出やすい、高齢者では血中濃度が高くなる為、推奨される投与量は10~20mg。
日本ではうつ病以外に全般性不安症を除く全ての不安症(パニック症、強迫性症、社交不安症)の適応となっています。
③セルトラリン(ジェイゾロフト):
ドーパミンにも作用→非定型うつ病に対する第一選択薬(Stahl)との記載もあり。女性に対する有効率が高いとのデータがありますが、非定型うつ病の7割が女性である事が要因とも考えられます。
半減期が長く、代謝産物も活性をもつ→退薬症状が出にくい。
アメリカではうつ病以外に全般性不安症を除く全ての不安症(パニック症、強迫性症、社交不安症)、PTSD、月経前不快気分障害(PMDD)の適応となっています。
④エスシタロプラム(レクサプロ):
セロトニンに対する選択性が高い。
脳内移行が強い→末梢性の副作用が少ない。
「アロステリック作用」により、作用部位であるセロトニン・トランスポーターに長時間結合(結合半減期130時間)→効果が強く持続し、離脱症状が出にくい。
初回投与量のまま増量不要。
女性に対する有効率がセルトラリンに次いで高いとのデータがあります。
ヨーロッパではうつ病以外に全ての不安症の適応(スウェーデンでは月経前不快気分障害(PMDD)にも適応)となっています。
(4)SNRI(セロトニン・ノルアドレナリン再取り込み阻害薬)(ミルナシプラン(トレドミン)、デュロキセチン(サインバルタ))、イフェクサーSR(ベンラファキシン) 三環系抗うつ薬と同等な抗うつ作用を持つ。
SSRIに比べると、効果発現が少し速く、1週間以内に効果がみられ、2週間後は効果が少しずつ高まってくると言われます。
三環系抗うつ薬のような抗コリン性の副作用や、心毒性、鎮静作用が少ない。
ノルアドレナリン特有の副作用→排尿障害、頻脈、血圧上昇
①ミルナシプラン(トレドミン):
主にノルアドレナリンに作用します。
アメリカでは線維筋痛症の適応となっています。
殆どが未変化体で尿中に排泄され、一部が肝でグルクロン酸抱合により代謝される→薬物相互作用の点で問題となる事は少ない。
尿閉(前立腺疾患等)には禁!
②デュロキセチン(サインバルタ):
主にセロトニンに作用します。
アメリカではうつ病以外に全般性不安症の適応となっています。
高度の肝障害・腎障害には禁!
③イフェクサーSR(ベンラファキシン):
デュロキセチンよりも更にセロトニン優位で、投与後まずセロトニンの効果が発現します。
アメリカではうつ病以外に強迫症を除く全ての不安症(全般性不安症、パニック症、社交不安症)の適応となっています。
脳内移行が強い→末梢性の副作用が少ない。
高度の肝障害・腎障害には禁!
(5)NaSSA(ノルアドレナリン・セロトニン作動性抗うつ剤)(ミルタザピン(リフレックス、レメロン))
- 既存の抗うつ薬は殆どがシナプスにおけるセロトニン、ノルアドレナリン再取り込み阻害薬でした。NaSSAはシナプスにおけるセロトニン、ノルアドレナリンの放出自体を促進します。
a1受容体遮断作用のある薬剤(例:三環系抗うつ薬、リスぺリドン、クエチアピン、オランザピン等)を併用すると、セロトニンの放出が減弱します。 - 効果発現が早く、強いと言われます。
- 非三環系のミアンセリン(テトラミド)と分子構造が似ており、深い睡眠を増やして悪夢や中途覚醒を軽減します(SSRIとは逆の作用)。
- 食欲増進による体重増加、投与初期に日中の眠気(老人ではこの副作用が出にくい、2~3日目をピークにやがて消失→服用開始は週末が最適(Friday Drug))がみられます。
(6)S-RIM(セロトニン再取り込み阻害・セロトニン受容体調節剤)(ボルチオキセチン(トリンテリックス))
セロトニン再取り込み阻害作用によるセロトニン濃度上昇に加え、セロトニン受容体調節作用によるセロトニン・ノルアドレナリン・ドパミン・アセチルコリン・ヒスタミンの遊離促進に関与します(*)。
(*)各神経伝達物質の主な働き:
セロトニン:気分に関与
ノルアドレナリン:ストレス制御に関与
ドパミン:意欲に関与
アセチルコリン:思考に関与
ヒスタミン:ホルモン分泌や睡眠などに関与
うつ病の回復に加え、うつ病回復後の残遺症状である感情鈍麻/アンへドニアや認知機能障害を改善する事により、社会機能の回復を促すと考えられています。
(7)その他(スルピリド(ドグマチール、アビリット))
- 我が国でのみ抗うつ薬として使われています。
- 高用量でシナプス後部のD2受容体遮断により抗精神病作用を示し、低用量ではシナプス前部のD2受容体を遮断しドパミン放出を促進し、抗うつ作用を示すとされます。150mgまでにとどめないと抗うつ効果はありません。
- 全般に軽症で多少のゆううつ感と身体愁訴が目立つ、いわゆる「仮面うつ病」に有効。
- 制吐作用を期待してSSRI投与初期の嘔気に対して併用もします。SSRIと併用するとSSRIの効果発現が早まるとの報告もあります。
- D2受容体遮断による副作用があります(抗精神病薬の項を参照)。
<薬物療法の実際>
うつ病の治療指針は絶対的なものではないので「アルゴリズム」と呼び、「ガイドライン」とは区別していました。
「アルゴリズム」には「問題解決のための段階的手法」という語義があります。
「アルゴリズム」における「うつ病」とはDSMの診断基準における「大うつ病」をさしており、そこでは「病因論」が排除されています。すなわち、「うつ病」とは「治療を要するうつ状態」という意味であり、一つの病気ではなく「うつ状態を呈する症候群」であって原因はまちまちです(うつ病の異種性)。うつ病にはいろんな種類や併存症があり、精神科の臨床にガイドラインやクリニカル・パスといったものがなじみにくい要因がそこにあると思われます。現在はうつ病の「治療ガイドライン」が国内外にいくつかありますが、それらのどれをとっても「うつ病の異種性や併存症の有無」を考慮されたものではありません。「うつ病の異種性や併存症の有無」を考慮した治療により、うつ病の難治性、再燃・再発といった問題はかなり解決すると考え、当院では「うつ病の異種性や併存症の有無」を考慮した治療を心がけています。
うつ病は、早期(6か月以内)に治療しないと治りにくくなると言われていますので、患者の予後を考えると、有効な薬剤を最初に選択し、十分量・十分期間投与する事が肝要です。
薬物選択の「アルゴリズム」や「ガイドライン」は、プライマリケア医に標準的な薬物療法を示唆するという点では有用ですが、「うつ病の異種性や併存症の有無」を考慮されたものではありません。従って、有効な薬剤を最初に選択する為には、画一的に「アルゴリズム」や「ガイドライン」を適用するのではなく、どのようなタイプのうつ病なのかを初診時に見極める事が大切です。
多くの抗うつ薬の用量は、日本では海外よりもかなり少量で認可されています。最大量で4~8週間は投与しないと効果の有無は判断できません。寛解後(完全に治った後)6カ月以上は急性期と同用量で治療継続しないと、うつ病がぶり返す恐れがあります。
<私の処方例>
うつ病の初期治療においては、まず身体疾患を除外した上で、「うつ病の異種性や併存症の有無」に留意して最初の治療薬を選択する事が重要かと思います。
1.双極性の素因をもつ→抗躁薬を主剤。
鑑別のポイントとして、下記の点を見逃さない事が重要です。
(1)初診時
- 過去に躁または軽躁エピソードがある
- 双極性の家族負因がある
(2)治療経過中
- 躁または軽躁エピソードが出現
- 抑うつ状態が「非定型の特徴」を有する
- ある日突然、抑うつ状態から脱する
- 抗うつ薬が無効(長期間かかった場合には、自然に治った可能性あり)
- 抗うつ薬でアクチベーションが生じる
- 抗躁薬を追加すると有効
2.精神病症状を伴う→抗精神病薬を併用。
3.重症で休職を要する→ノルアドレナリンにも作用する薬剤でないと寛解しにくいとも言われている為、SNRI、ミルタザピン、ボルチオキセチンを単剤または併用。
4.不安障害を背景にもつ→不安障害も治療する必要がある為、まずはSSRIを主剤とし、抗うつ効果が不十分ならミルタザピンまたはミルナシプラン(中高年男性では尿閉に注意)を追加。または最初からベンラファキシン、ボルチオキセチン単剤。
(1)若年男性→性機能障害の少ないエスシタロプラム、またはフルボキサミン(併用薬剤に注意)を主剤。
(2)若年女性→若年女性に有効率の高いセルトラリンを主剤。
(3)(1)または(2)で不安障害に対する効果が不十分→パロキセチンに変更。
5.非定型うつ病→セルトラリンを主剤(Stephen M.Stahl)とし、抗うつ効果不十分ならミルタザピンを併用、気分の波、怒り発作、不安抑うつ発作にはバルプロ酸200~400mg、鉛様の麻痺にはブロナンセリン2mgを併用。
6.老人→老人のうつに多い不眠、食欲低下、不安、焦燥に有効で、投与初期の副作用である眠気等が老人では出にくいミルタザピンを主剤。妄想や認知機能の改善を期待する場合にはフルボキサミンを単剤または併用。
7.上記以外の中等症のうつ病→ノルアドレナリンにも作用する薬剤でないと寛解しにくいとも言われている為、SNRI、ミルタザピンを単剤または併用。
1.~3.は精神科での治療が必要ですが、4.~7.はプライマリケアでも治療可能と思われます。
<増強療法augmentationと併用療法combination>
まずは単剤で十分量・十分期間投与する事が基本ですが、必要に応じて薬剤を追加します。
抗うつ剤の単剤で効果が不十分な場合、①抗うつ剤の変更、②抗うつ剤の併用療法、③増強療法、の選択枝があります。増強療法は短期間で効果が発現するという利点があります。
当院では、なるべく抗うつ剤は単剤でうつ病、不安症のいずれに対しても十分な効果を期待できるベンラファキシン、ボルチオキセチンを第一選択とし、非定型うつ病にはセルトラリンを第一選択とし、抗うつ効果が不十分な場合に増強療法を選択するようにしています。
1.増強療法:
「増強療法」とは、抗うつ薬に気分安定薬(リチウム)や抗てんかん薬(バルプロ酸、カルバマゼピン)、新規抗精神病薬(アリピプラゾール、プレクスピプラゾールなど)を追加する事。
増強療法が有効な場合は、双極性の素因を持っている可能性が考えられ、リチウムによる増強療法が有効な患者の3/4は双極性障害であるとのデータがあります。
双極性の素因を持つ患者には炭酸リチウム等、双極性の素因のない患者にはアリピプラゾール、プレクスピプラゾール等が主な選択肢となります。
アリピプラゾールと比較してプレクスピプラゾールには多彩な作用機序があるとされます。
アリピプラゾール、プレクスピプラゾールいずれも開始後1週間以内に(平均3~4日目)効果がはっきりと現れ、いずれも当たり外れがはっきりしています。
アリピプラゾールは6mgまでは増量により効果が増大しますが、それ以上増量しても著変ありません。プレクスピプラゾールは1mgで効果不十分な場合は2mgに増量します。
プレクスピプラゾールには性機能障害を改善する作用があり、アリピプラゾールと比較してアカシジア(足がそわそわする副作用)は少ない。
SSRIやベンラファキシンの副作用として性機能障害がみられるため、プレクスピプラゾールを追加する利点が大きいと考えられます。
アリピプラゾールには効果の中折れがあります。
2.併用療法:
「併用療法」とは、抗うつ薬を併用する事。
相加効果、相乗効果や副作用の相殺が期待できる組み合わせを選択。
(現在は、抗うつ剤を2剤併用すると診療報酬が削られるようになっており、併用療法が難しくなっています。)
(1)相加効果が期待できる組み合わせの例:
SSRI+ボルチオキセチンまたはミルナシプラン
(2)相乗効果が期待できる組み合わせの例:
SNRI+NaSSA=カリフォルニアロケット燃料(Stephen M.Stahl)
(3)副作用の相殺が期待できる組み合わせの例:
SSRI+スルピリド→SSRIによる嘔気を軽減し、効果発現を早める。
SSRI+トラゾドン→SSRIによる睡眠障害、性機能障害、賦活症候群を軽減。
SSRI+NaSSA→SSRIによる睡眠障害、性機能障害、嘔気を軽減。
<抗うつ薬による排尿障害のメカニズム>
膀胱はアセチルコリンの刺激により収縮し、尿道はノルアドレナリンのα1刺激により収縮します。
1.三環系抗うつ薬の場合:
コリン受容体遮断作用、α1受容体遮断作用共にあり
→ノルアドレナリンα刺激による尿道収縮はないが、コリン受容体遮断による膀胱収縮抑制
→排尿障害
2.SNRIの場合:
コリン受容体遮断作用、α1受容体遮断作用共になし
→コリン受容体遮断による膀胱収縮抑制はないが、ノルアドレナリンα1刺激による尿道収縮
→排尿障害
<賦活症候群(アクチベーションシンドローム)>
若年者に抗うつ薬、特にSSRIを処方すると希死念慮や衝動性・攻撃性が増すと言われ、同じく若年者に多いとされるアクチベーション・シンドロームとの関連も示唆されています。しかし、現段階では、抗うつ薬と希死念慮や衝動性・攻撃性の問題については一定の見解は得られておらず、アクチベーション・シンドロームの本態が何かという事もわかっていません。次に述べるセロトニン症候群のごく軽微な形と言えないこともありません。アクチベーションを生じるという事は、うつ病中核群ではない事(双極性障害、パーソナリティー障害、等)を示しているとも言われています。
<MANGA study(2009年)>
12種類の新規抗うつ薬の大規模比較試験。結果については議論のあるところですが、有効性(治療反応性)と受容性(治療継続性:副作用が少なく中断率が低い事)からみた使いやすさの順位は、1位:エスシタロプラム(レクサプロ)、2位:セルトラリン(ジェイゾロフト)、3位:ミルタザピン(リフレックス、レメロン)、4位ミルナシプラン(トレドミン)・・・となっています(有効性ではミルタザピン、受容性ではエスシタロプラムが1位)。
<セロトニン・トランスポーターの遺伝子多型について>
シナプス間隙においてセロトニンの再取り込みをする部位をセロトニン・トランスポーターと呼び、SSRIはセロトニン・トランスポーターにおける再取り込みを阻害する事により効果を発揮します。セロトニン・トランスポーターの遺伝子型にはSS型、SL型、LL型があり、日本人ではSS型が8割、LL型が1割未満、欧米人ではLL型が6割を占め、パロキセチンはSS型に、フルボキサミンはLL型に反応率が高いとのデータがありますが、セルトラリン、エスシタロプラムについてはそういったデータはまだありません。SS型は幼少期の虐待による影響を受けやすく、LL型は服薬遵守しない人が多いとのデータがあります。
<セロトニン症候群(SS)について>
1.症状と診断
(1)精神症状:失見当識や錯乱といった意識障害や、不安・焦燥感や落ち着きのなさ、軽躁状態などが特徴的。
(2)神経・筋症状:健反射亢進やミオクローヌス(筋肉のピクピクとした細かいけいれん)、筋強剛、振戦、失調など。
(3)自律神経症状:発熱、下痢、発汗、頻脈、血圧不安定など。
2.鑑別診断
- 臨床上最も鑑別が問題視されるのは悪性症候群(NMS)です。SSではだいたい発症も改善も24時間以内であるのに対し、NMSでは1週間前後と期間が長い。発熱、自律神経症状では共通するものの、神経筋症状として錐体外路症状はどちらでも発現しますが、NMSではほぼ必発です。SSではミオクローヌスや腱反射の亢進が特徴的です。精神症状の違いも重要であり、SSでは不安、焦燥感、錯乱、軽躁状態など独特の「落ち着かなさ」であるのに対して、NMSでは意識障害もしくは緊張病症候群が中心です。
<悪性症候群とセロトニン症候群の比較>
| 悪性症候群 | セロトニン症候群 | |
| 原因薬物 | ドーパミン拮抗薬 | セロトニン作動薬 |
| 症状の発現 | 数日から数週間 | 数分から数時間以内 |
| 症状の改善 | 平均9日 | 24時間以内 |
| 発熱(38℃以上) | 90%以上 | 46% |
| 意識状態の変化 | 90%以上 | 54% |
| 自律神経症状 | 90%以上 | 50~90% |
| 筋強剛 | 90%以上 | 49% |
| 白血球増加 | 90%以上 | 13% |
| CPK上昇 | 90%以上 | 18% |
| GOT/GPT上昇 | 75%以上 | 9% |
| 代謝性アシドーシス | しばしば | 9% |
| 腱反射亢進 | 稀 | 55% |
| ミオクローヌス | 稀 | 55% |
3.治療と予後
原因薬剤の中止。SSの予後は一般には良好で、70%の症例は24時間以内に改善するとされています。
(6)抗躁薬
(1)気分安定薬①リチウム(リーマス)
抗躁効果、病相予防効果、抗うつ効果の全てを持ち、おそらくは衝動性の改善等を介して自殺を予防する作用をも持っており、躁うつ病治療の基本薬剤です。効果発現に1週間かかります。併用で抗うつ薬の作用を増強します(リチウム増強効果)。神経保護作用(*)があります。
リチウム中毒に注意!
消化器症状(嘔吐、下痢など)
→ 中枢神経症状(振戦、失調、けいれん、錯乱、昏睡)
→ 死亡
したがって、注意深い薬物血中濃度のモニターが必要です(1.2mEq/l以下に保つ)。
(*)神経保護作用について:
脳の神経細胞変性の原因としては、下記の3つがあると言われています。
(1)アポトーシス(プログラム細胞死)の促進
(2)BDNF(脳由来神経栄養因子)等の減少
(3)神経新生の減少
リチウムの直接の作用点として昔から有名なGSK3-βという物質が神経保護作用に関与しており、GSK3-βが活性化状態になると前述の(1)~(3)が生じ、GSK3-βを抑制すると神経保護作用を発揮します。
アリピプラゾールやオランザピンを始めとする新規抗精神病薬、リチウムを始めとする抗躁薬や抗うつ薬は、途中までの作用機序は異なるものの、GSK3-βを抑制する事により神経保護作用を有すると言われています。
部分発作を伴うてんかんにおいて第一選択薬となる抗てんかん薬。
抗躁効果、病相予防効果を持つ。
リチウム無効例にも有効。
カルバマゼピンが病相予防に有効な双極性障害患者の特徴としては、
- 躁病相がうつ病相に比して長い(2倍以上)。
- これらの病相の間に寛解期があり、躁転、うつ転がない。
- 30歳以前の発症。
- 非定型的な特徴(精神病症状や錯乱を示す)。
酵素誘導を起こして薬物代謝を促進し多くの薬物血中濃度を下げることがあります。
まれだが重篤な副作用としては発疹があり、重症化するとスティーブンス・ジョンソン症候群と呼ばれ、肝障害などの全身症状をきたします。発疹が出たら早めに中止します。
③バルプロ酸(バレリン、セレニカ)
全般性発作を伴うてんかんにおいて第一選択薬となる抗てんかん薬。
リチウム無効例にも有効。
急速交替型、混合状態や不機嫌な躁病に有効と言われています。
気分安定薬の中では比較的副作用が少ない。
④ラモトリギン(ラミクタール)
抗てんかん薬として開発され、後に双極性障害のうつ状態の再発予防効果が確立し、うつ状態の急性期に対する作用も示唆されています。
まれだが重篤な副作用としては発疹があり、重症化するとスティーブンス・ジョンソン症候群と呼ばれ、肝障害などの全身症状をきたします。発疹が出たら早めに中止します。
(2)抗精神病薬
副作用の観点から非定型抗精神病薬の方が望ましい(抗精神病薬の項を参照)。
<代表的な抗躁薬の双極性障害への有効性>
| 薬品名 |
有効性
|
||
| 躁 | 予防 | うつ | |
| <気分安定薬> | |||
| リチウム(リーマス) | ○ | ○ | ○ |
| バルプロ酸(バレリン、セレニカ) | ○ | △ | △ |
| カルバマゼピン(テグレトール) | ○ | △ | × |
| ラモトリギン(ラミクタール) | × | ○ | △ |
| <非定型抗精神病薬> | |||
| オランザピン(ジプレキサ) | ○ | ○ | △ |
| リスぺリドン(リスパダール) | ○ | △1) | × |
| クエピアチン(セロクエル) | ○ | ○2) | ○ |
| アリピプラゾール(エビリファイ) | ○ | ○ | × |
1):デポ注射剤。気分安定薬への追加投与
2):リチウムまたはバルプロ酸への追加投与
表の補足:
日本うつ病学会治療ガイドラインI.双極性障害2020 I.双極性障害治療ガイドラインサマリー 第2章 抑うつエピソードの治療 (2020年6月改訂)
推奨される治療
・クエチアピン(徐放錠)(300mg/日)[クエチアピン徐放錠以外は本邦未承認効能]
・リチウム(0.8mEq/Lを超える血中濃度に到達後、最低でも8週間は経過観察を行う)[本邦未承認効能]
・オランザピン(5‾20mg/日)
・ルラシドン(20-60mg/日)(*)
・ラモトリギン(200mg/日、HRSD得点が25点以上の症例)[本邦未承認効能]
(*)ルラシドン(ラツーダ)について
ヒスタミンH1、ムスカリンM1受容体に対しては結合親和性を殆ど示さない為、体重増加や過鎮静、口渇、便秘などの副作用は非常に少ない。強いセロトニン5-HT7拮抗作用を持ち、双極性障害の抑うつ症状に対する第一選択薬となりうる。20mgで有効性が見られれば、必ずしも増量する必要はない。気分安定薬(リチウムまたはバルプロ酸)で加療中の患者が抑うつ症状を示した際に、さらなる改善を得ようとして薬を追加したい場合に、効果のエビデンスがある抗精神病薬はルラシドンのみ。空腹時に服用すると吸収が低下し血中濃度が十分上昇しない為、1日1回食後投与する(期待する血中濃度を得るには350kcal以上の食事量が目安)。
<薬物療法の実際>
躁状態の治療から既に再発予防が始まるといった観点から、リチウムが第一選択とされています。
不機嫌、易怒性等を認める中等度以上のケースでは、オランザピンをはじめとする非定型抗精神病薬やバルプロ酸等を組み合わせて治療していきます。
(7)抗不安薬
抗不安薬とは、不安・緊張を軽減させる向精神薬全般をさし、主に神経症圏に用いられる薬物です。現在はベンゾジアゼピン系薬物が主流。
ベンゾジアゼピン系薬物には、
(1)抗不安作用、(2)鎮静・催眠作用、(3)筋弛緩作用、(4)抗けいれん作用、(5)抗うつ作用があり、
| (1) | 抗不安作用の強いものは抗不安薬として、 |
| (2) | 鎮静・催眠作用の強いものは鎮静・催眠薬として、 |
| (3) | 筋弛緩作用の強いものは肩こり、筋緊張性頭痛(頭部の筋緊張により発痛物質が生じておこる。慢性頭痛の40%を占める。エチゾラム(デパス)は第一選択薬)、頸部痛、腰痛の治療薬として、用いられます。 |
(1)ベンゾジアゼピン系
- GABAは中枢性の抑制性神経伝達物質
- ベンゾジアゼピン系ω受容体とGABA(ガンマアミノ酪酸)のGABA A受容体が表裏一体になっており、ベンゾジアゼピン系薬物がω受容体に結合する事により
→ GABAがGABA A受容体に結合しやすくする
→ 鎮静・催眠作用(ω1受容体)、抗不安・筋弛緩作用(ω2受容体) - アルコールと併用すると、奇異反応(異常行動)や、前向性健忘という副作用が増強されます!
- 依存性は強くはありませんが、急に止めると退薬症状が現れる事もあります。
- 急性狭隅角緑内障、重症筋無力症には禁!
①短時間型:
1)不安発作(パニック発作)に対する頓用に有用
2)連用後に中断すると反跳性不安・退薬徴候を起こしやすい
②長時間型:
1)服用回数を削減できます
2)依存者の離脱に有用
3)連用によって体内蓄積を起こすおそれがあります
③高力価短時間型:
健忘やせん妄・錯乱の報告があります
<抗不安薬の作用特性>
| 分類 | 力価 | 一般名(販売名) | 最高血中濃度 到達時間 (約時間) |
血中半減期 (約時間) |
|||||
| 抗不安 | 鎮静・催眠 | 筋弛緩 | 抗痙攣 | 抗うつ | |||||
| 短時間 | 高 | エチゾラム (デパス) |
3 | 6 | +++ | +++ | ++ | – | ++ |
| 低 | クロチアゼパム (リーゼ) |
1 | 5.8~6.3 | ++ | ± | ± | |||
| 中時間 | 高 | ロラゼパム (ワイパックス) アルプラゾラム (コンスタン、 ソラナックス) |
2 2 |
12 14 |
+++ ++ |
++ ++ |
+ ± |
– – |
+ ++ |
| 中 | ブロマゼム (レキソタン) |
1 | 8~19 | +++ | ++ | +++ | +++ | + | |
| 長時間 | 高 | フルジアゼム (エリスパン) ジアゼパム (セルシン、ホリゾン) |
1 1 |
23 27~28 |
++ ++ |
++ +++ |
++ +++ |
± +++ |
– + |
| 中 | クロキサゾラム (セパゾン) クロルジアゼポキシド (コントール) |
未記載1 | 11~21 6.6~28 |
+++ ++ |
+ +++ |
+ + |
– ± |
++ – |
|
| 超長時間 | 高 | ロフラゼプ酸エチル (メイラックス) |
1(錠) 1.2(細粒) |
110(錠) 110(細粒) |
++ | + | ± | ++ | + |
(2)アザピロン誘導体(タンドスピロン(セディール)など)
- セロトニンは大脳辺縁系における不安誘発物質。
- セロトニン1A受容体作動→神経からのセロトニン遊離抑制→抗不安作用
- ベンゾジアゼピン系薬物の副作用がないか弱い上に、不安と抑うつに特異的に作用します。即効性はありません。
(8)睡眠薬
(1)バルビツール系(現在は、安全性や依存性等の問題が大きい為、殆ど使いません)
- 耐性(効果が薄れ、服用量が増える)を生じ、依存性が高く、大量で呼吸停止。
- 現在では非常に頑固な不眠に対して適時投与。
- 酵素誘導を起こして薬物代謝を促進し多くの薬物血中濃度を下げることがあります。
(2)ベンゾジアゼピン受容体作動薬(ベンゾジアゼピン系および非ベンゾジアゼピン系:ともに作用機序は同じで、前述の「(7)抗不安薬-(1)ベンゾジアゼピン系」の項を参照)
バルビツール系に比べ、耐性・依存性は低く安全性は高い。ベンゾジアゼピン系よりも非ベンゾジアゼピン系の方が耐性・依存性は低い。
「睡眠薬の適正使用・休薬ガイドライン」の主軸である「出口を見据えた不眠症医療」に適した薬物療法として、専門医の間では、第1に非ベンゾジアゼピン系、第2にメラトニン受容体作動系と、睡眠薬の選択順位についてコンセンサスが得られています。ベンゾジアゼピン系は、これらの薬剤で治療がうまくいかなかった場合に使用を考慮するという位置づけです。
(1)、(2)ともに催眠作用をもたらす作用機序はGABAを介したニューロンの抑制機能を増強することにありますが、(1)の方が広範囲に受容体が分布する為、作用が強い。
睡眠薬を選ぶにあたっての二つの大事なポイントは、作用発現の速さと作用時間です(入眠障害では、作用発現が速く短時間作用型の薬剤、早朝覚醒では中(長)時間型の薬剤が適します)。短時間型の薬物は蓄積しませんが、反跳性の不眠を引き起こすことがあります。
<用量、薬物動態>
| 分類 | 一般名(販売名) | 臨床用量(mg) | 最高血中濃度到達時間 (時間) |
消失半減期 (時間) |
| 超短時間型 | ゾルピデム(マイスリー) *** | 5~10 | 0.7~0.9 | 2 |
| トリアゾラム(ハルシオン) | 0.125~0.5[0.25] | 1.2 | 2~4 | |
| ゾピクロン(アモバン) *** | 7.5~10 | 0.75~1.17 | 4 | |
| エスゾピクロン(ルネスタ) *** | 1~3 | 1 | 5 | |
| 短時間型 | ブチゾラム(レンドルミン) | 0.25~0.5 | 1.5 | 7 |
| リルマザホン(リスミー) | 1~2[2] | 3 | 10 | |
| エチゾラム(デパス) * | 0.5~3 | 3 | 6 | |
| ロルメタゼパム (エバミール、ロラメット) |
1~2[2] | 1~2 | 10 | |
| 中時間型 | 二トラゼパム (ベンザリン、ネルボン) |
5~10 | 1.6 | 28 |
| フルニトラゼパム (ロヒプノール、サイレース) |
0.5~2[1] | 1~2 | 24 | |
| エスタゾラム(ユーロジン) | 1~4 | 5 | 24 | |
| ニメタゼパム(エリミン) | 3~5 | 2~4 | 21 | |
| 長時間型 | グアゼパム(ドラール) ** | 15~30 | 3.4 | 36 |
| フルラゼパム (ダルメート、ベノジール) |
10~30 | 1 | 65 | |
| ハロキサゾラム(ソメリン) | 5~10 | 1 | 85 | |
| ロフラゼプ酸エチル (メイラックス) * |
2 | 1.0~1.2 | 110 |
[ ]高齢者用量 *抗不安薬 **ω1選択性→抗不安・筋弛緩作用は殆どありません ***非ベンゾジアゼピン系
<GABA A受容体のサブユニットの薬理学的特性>
GABA A受容体はω1・2受容体と呼ばれてきましたが、現在の知見ではω1はα1サブユニット、ω2はα2・3・5サブユニットに分類できます。
α1サブユニットは睡眠効果よりも鎮静効果が強く、依存形成に関与し、抗けいれん作用や前向性健忘の発現にも関わります。
α2サブユニットは睡眠・覚醒スイッチに関与するとともに抗不安作用を有し、α3サブユニットも睡眠との機能的関連性が高く、抗不安・抗うつ・筋弛緩に関連します。
α5サブユニットは学習・記憶や耐性に関わっていると考えられています。
| GABA A受容体サブタイプ | 効果 | 副作用 | ||||||
| 睡眠 | 鎮静 | 抗不安 | 筋弛緩 | 抗けいれん | 健忘 | 依存 | 耐性 | |
| α1サブユニット | △ | ○ | ○ | ○ | ○ | |||
| α2サブユニット | ○ | ○ | ○ | |||||
| α3サブユニット | ○ | ○ | ○ | |||||
| α5サブユニット | ○ | ○ | ○ | |||||
非ベンゾジアゼピン系のGABA A受容体のサブユニットに対する最大効力:
ゾルピデム(マイスリー) はα1サブユニットに対する効力が他のαサブユニットへの効力に比して強い(α1>>α2,α3,α5)。
ゾピクロン(アモバン)はα1およびα5サブユニットに対する効力がα2およびα3サブユニットへの効力よりもやや強い(α1,α5>α2,α3)。
エスゾピクロン(ルネスタ)はα1サブユニットに対する効力は比較的弱く、その効力の強さはα2およびα3サブユニットに対する強さより弱い(α2,α3>α1,α5)。
とされています。
(3)メラトニン受容体作動薬系(ラルメテオン(ロゼレム))
睡眠には、2つのメカニズムがあります。1つは「夜になったから眠る」という体内時計(概日リズム)機構と呼ばれるメカニズムで、もう1つは「疲れたから眠る」という恒常性維持機構と呼ばれるメカニズムです。
体内時計機構では、夜に松果体から分泌されるメラトニンというホルモンにより睡眠が誘発されます。
ラルメテオン(ロゼレム)はメラトニン受容体に作用する事で体内時計機構に働きかけ、睡眠と覚醒のリズムを整える事で脳と身体の状態を覚醒から睡眠へ切り替えて、鎮静作用や抗不安作用によらない睡眠を誘導します。
1~2週間服薬継続しているうちに効果が出てきます。
(4)オレキシン受容体拮抗薬(スボレキサント(ベルソムラ)、レンボレキサント(デエビゴ))
オレキシンは、視床下部のニューロンから産生される神経ペプチドであり、覚醒の調節に重要な働きをしている事が最近の研究で明らかとなっています。
スボレキサント(ベルソムラ)、レンボレキサント(デエビゴ)は、オレキシンの受容体への結合をブロックし、過剰に働いている覚醒システムを抑制する事で、脳を生理的に覚醒状態から睡眠状態へ移行させ、本来の眠りをもたらします。
(9)ADHD治療薬
ADHDの症状には、自分の注意や行動をコントロールする脳の働き(実行機能)のかたよりが関係していると考えられていますが、詳しい原因はまだわかっていません。
(1)前頭前野の関連
実行機能は前頭前野とよばれる大脳の前側の部分で調節されます。ADHDの人は、前頭前野を含む脳の働きにかたよりがあると考えられています。
(2)神経伝達物質の関連
また、脳の神経伝達物質(脳内の神経細胞の間で情報をやり取りする物質)であるドパミンやノルアドレナリンの働きがADHDの人では不足気味であることがわかっています。これらの神経伝達物質の機能が十分に発揮されないために、ADHDの症状である不注意や多動性があらわれるのではないかと考えられています。
最近では、神経伝達物質の不足を改善し、情報伝達をスムーズにする薬が登場しています。
| 分類 | 中枢神経刺激薬 | 非中枢神経刺激薬 | |
| ドパミン、ノルアドレナリン 再取り込み阻害薬 |
選択的ノルアドレナリン 再取り込み阻害薬 |
選択的α2Aアドレナリン 受容体作動薬 |
|
| 一般名 (商品名) |
メチルフェニデート (コンサータ錠) |
アトモキセチン塩酸塩 (ストラテラカプセル、内用液) |
グアンファシン塩酸塩 (インチュニブ錠) |
| 対象年齢 | 6歳以上(成人にも適応あり) | ||
| 服用回数 | 1日1回 | 18歳未満:1日2回 18歳以上:1日1~2回 |
1日1回 |
| 特徴 | ・服用1~2時間後から効果を発現し、 約12時間効果が持続する ・処方、調剤にはコンサータ錠適正流通管理委員会への登録が必要 |
・効果が1日中持続する ・効果が発現するまでの期間が長く、十分な効果を得るためには4~8週程かかることがある |
・効果が1日中持続する ・投与開始後1~2週から症状改善がみられる ・食欲低下などが起きにくい |